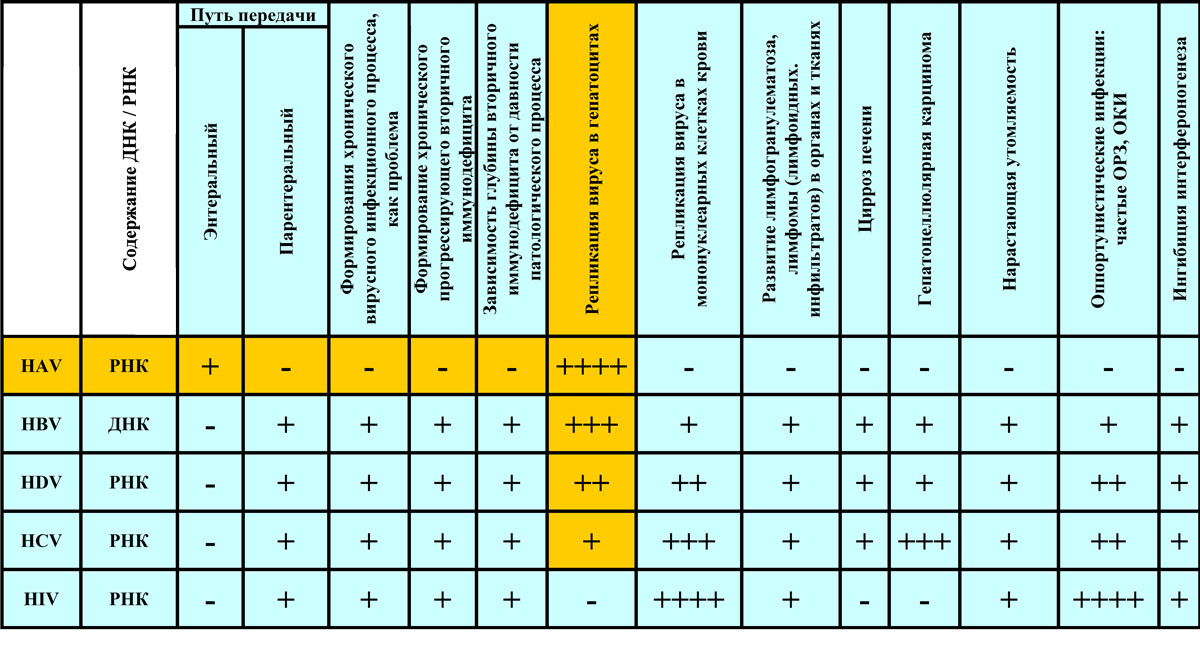
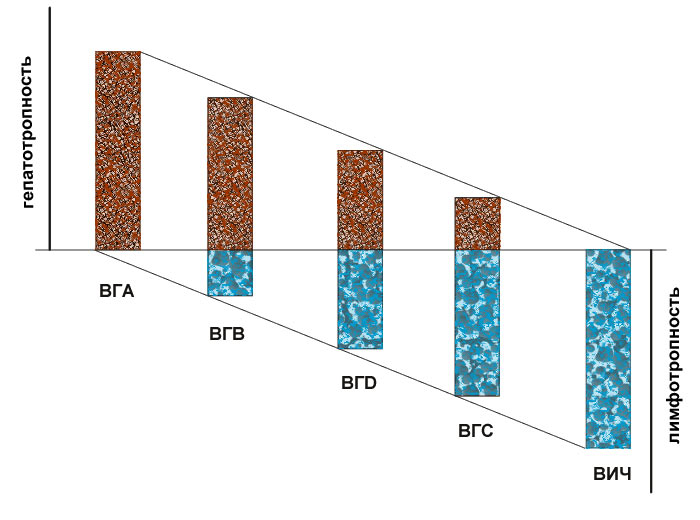
Настоящий способ обнаружения лимфотропных вирусов предназначается:
- для повышения достоверности определения инфицированности биологических сред вирусом гепатита В (HBV), вирусом гепатита С (HCV) или вирусом иммунодефицита человека (HIV), обладающих лимфотропизмом; - для исключения ложноотрицательных реакций при тестировании донорской крови и пациентов на предмет зараженности HBV, HCV или HIV; - для обнаружения HBV, HCV или HIV в биологическом материале (донорская кровь, плазма и другие производные крови) с концентрацией вирусных частиц ниже порога чувствительности метода ИФА и ПЦР; - для оценки жизнеспособности вирусов после воздействия химических и физических противовирусных факторов, разрабатываемых и предлагаемых производителями в целях инактивации вирусов в практическом здравоохранении.
Данный способ не имеет аналогов.
ПРЕЗЕНТАЦИЯ СПОСОБА

VI СПОСОБ ОЦЕНКИ IN VITRO ЖИЗНЕСПОСОБНОСТИ ЛИМФОТРОПНЫХ ВИРУСОВ HBV, HCV и HIV.
- Получение взвеси HBV, HCV или HIV. Для получения взвеси вирусов у больных зараженных моноинфекциями HBV, HCV или HIV, с заранее известной высокой вирусной нагрузкой из локтевой вены производится забор крови. Из цельной крови выделяется вируссодержащая сыворотка, которая подвергается количественному ПЦР исследованию для подтверждения наличия HBV, HCV или HIV и определения титра вирусов. Вируссодержащая сыворотка хранится в замороженном состоянии в минусовом холодильнике при температуре ниже – 25оС.
- Получение взвеси лимфоцитов здорового человека.
- Здоровые люди — добровольцы методом ИФА тестируются на предмет зараженности HBV, HCV и HIV. В испытаниях используются лимфоциты здоровых людей только с отрицательными результатами тестирования;
- Для получения достаточного количества взвеси лимфоцитов кровь забирается у здорового человека (добровольца) утром натощак из локтевой вены в количестве 30-40 мл. Далее кровь по 7-8 мл переносится в центрифужные пробирки, содержащие 2 мл физиологического раствора с 3 каплями гепарина. Смесь в пробирке тщательно перемешивается;
- Выделение лимфоцитов из цельной гепаринизированной крови проводят путем разделения в градиенте фиколл-верографин с плотностью d=1,077 г/мл по методу Ф.Ю. Гариб с соавт. (1995). Для этого в чистые центрифужные пробирки наливают по 2 мл градиента фиколл-верографина, на его поверхность осторожно наслаивается гепаринизированная кровь и пробирки центрифугируются при 1500 об/мин. В процессе центрифугирования все форменные элементы крови, кроме лимфоцитов, проникают через толщу градиента фиколл-верографина и находятся под ним. Плазма крови остается над градиентом. В толще градиента образуется своеобразное мутное кольцо («облако»), состоящее из взвеси лимфоцитов. Это кольцо с лимфоцитами осторожно отсасывается с помощью пипетки и переносится в чистую центрифужную пробирку;
- Далее проводится 2х-3х кратное промывание лимфоцитов в 10,0 мл физиологического раствора.После последнего центрифугирования удаляется надосадочная жидкость. Осадки, содержащие лимфоциты, разбавляются в 500 мкл физиологического раствора и перемешиваются. Взвесь лимфоцитов из всех пробирок сливаются в одну пробирку. Взвесь лимфоцитов можно хранить не более 1 суток при температуре + 4оС.
Оценка in vitro способности вирусов HBV, HCV или HIV проникать в цитоплазму лимфоцитов человека.
- HBV, HCV или HIV содержащая плазма вынимается из минусового холодильника, оттаивается при комнатной температуре.
- В чистую пробирку с помощью автоматической пипетки переносится равный объем (по 300 мкл) вируссодержащей плазмы и взвеси лимфоцитов, содержимое перемешивается и ставится на инкубацию (инкубация вирусов с лимфоцитами in vitro) в термостат при температуре +37оС на 6-8 часов. Содержимое пробирки перемешивается путем встряхивания каждые 1,5-2 часа. При инкубации в цитоплазму лимфоцитов проникают только жизнеспособные вирусы, которые проявляют цитопатогенное действие.
- Отмывание лимфоцитов от плазмы. Далее пробирка вынимается из термостата. В нее добавляется 6-8 мл физиологического раствора, перемешивается и центрифугируется при 1500 об./ мин. Происходит осаждение лимфоцитов на дно пробирок. Надосадочная жидкость удаляется. Далее производится 2х-3х кратное промывание в физиологическом растворе и осаждение лимфоцитов.
- После последнего центрифугирования и удаления надосадочной жидкости взвесь лимфоцитов (осадок) разбавляется в 500 mkl физиологического раствора и переносится в эпиндорф.
- После этого для разрушения лимфоцитов эпиндорф ставится в морозильную камеру бытового холодильника на 17-18 часов. При медленном замораживании происходит разрушение мембран лимфоцитов.
- Надосадочная жидкость из эпиндорфа отсасывается и подвергается количественному ПЦР-исследованию на предмет выявления в содержимом цитоплазмы лимфоцитов ДНК либо РНК вирусов, которые содержались ранее в плазме крови от больных.Оценка результатов.
- Положительный результат ПЦР-исследования на наличие РНК или ДНК вирусов в содержимом цитоплазмы лимфоцитов свидетельствует о сохранении жизнеспособности вирусов, то есть об их способности проникать и персистировать в лимфоцитах человека in vitro.
- Отрицательный результат ПЦР исследования на наличие РНК или ДНК вирусов в содержимом цитоплазмы лимфоцитов свидетельствует об утрате жизнеспособности (инактивации) вирусов (после воздействия на них антивирусных факторов химической или физической природы), то есть об утрате их способности проникать и персистировать в лимфоцитах человека in vitro.
VII СПЕКТР ПРИМЕНЕНИЯ СПОСОБА ОБНАРУЖЕНИЯ И ОЦЕНКИ ЖИЗНЕСПОСОБНОСТИ ЛИМФОТРОПНЫХ ВИРУСОВ HBV, HCV и HIV.
- Станции переливания крови: для повышения достоверности обнаружения лимфотропных вирусов гепатита В (HBV), гепатита С (HCV) и вируса иммунодефицита человека (HIV) в биологических средах (донорская кровь, плазма и другие компонеты), содержащих вирусы в концентрациях ниже порога чувствительности методов ИФА или ПЦР.
- Диагностические лаборатории: для повышения достоверности и исключения ложноотрицательных результатов при тестировании на предмет зараженности HBV, HCV или HIV крови доноров или пациентов с содержанием вирусов в концентрациях ниже порога чувствительности методов ИФА или ПЦР.
- Фармацевтические компании: для оценки жизнеспособности вирусов HBV, HCV или HIV после воздействия химических и физических противовирусных факторов, разрабатываемых и предлагаемых производителями в целях интактивации вирусов на различных объектах.
- Способ позволяет исключить ошибки при диагностике у пациентов, при тестировании донорской крови и её компонентов на предмет зараженности лимфотропными вирусами HBV, HCV или HIV. Способ создаёт возможность объективно оценить эффекти химических или физических факторов на жизнеспособность (патогенность) лимфотропных вирусов.
- Способ обнаружения и оценки жизнеспособности лимфотропных вирусов аналогов не имеет.
- Данный способ зарегистрирован Министерством здравоохранения Республики Узбекистан
Автор: Гулямов Нариман Гулямович, доктор медицинских наук, профессор